本指南适用于宫颈鳞癌、腺癌及腺鳞癌,不适合用于部分特殊病理类型,如小细胞癌、透明细胞癌、肉瘤等少见病理类型的宫颈癌。
一、概述
子宫颈癌是常见的妇科恶性肿瘤之一, 发病率在我国女性恶性肿瘤中居第二位。近年来,子宫颈癌的平均发病年龄在逐渐降低,有年轻化趋势。因此,十分有必要在全国范围内规范宫颈癌的诊断与治疗。
二、病因学
宫颈发生癌变的过程中,HPV感染是最为关键的环节。在妇女一生中,感染高危型HPV(如HPV16、18、31、33、35、39、45、51、52、56、58、59、68型)的概率达70%以上,但80%的妇女HPV感染为一过性,只有不到10%的妇女发展成宫颈癌或宫颈上皮内瘤变(CIN)。外源性的行为性危险因素包括初次性生活开始年龄小、多个性伴侣或性伴侣有多个性伙伴、性卫生不良、早婚早育、多孕多产、经期/产褥期卫生不良、吸烟、自身免疫性疾病或者长期免疫抑制、营养状况不良等。
三、临床表现
宫颈癌前病变和宫颈癌早期可以没有任何症状,随着病变严重程度的增加,会出现出血、异常白带以及肿瘤侵犯其他器官所导致的相应症状。
宫颈浸润癌(IB1期以上)通过妇科检查可发现宫颈肿物,大体上可分为菜花型、结节型、溃疡型以及颈管型,颈管型有时候表现为宫颈表面光滑,仅宫颈管明显增粗,质地变硬。如果阴道受侵可发现阴道穹窿或阴道壁肿瘤;宫旁受累患者妇科检查三合诊可发现宫旁增厚。
四、诊断检查
1、宫颈/阴道细胞学涂片检查及HPV检测
这是现阶段发现早期宫颈癌及癌前病变(CIN)的初筛手段,特别是对临床体征不明显的早期病变的诊断。
2、阴道镜检查
它对发现子宫颈癌前病变、早期子宫颈癌,以及确定病变部位有重要作用。
3、妇科检查
2022版中国指南仍然强调,妇科检查是临床分期的最重要手段,临床分期需要两名副高以上职称妇科医生决定,分期一旦确定, 治疗后不能改变分期。
4、肿瘤标志物检查
它可以协助诊断、疗效评价、病情监测和治疗后的随访监测,尤其在随访监测中具有重要作用。
5、影像学检查
影像学检查的价值主要是对肿瘤转移、侵犯范围和程度的了解(包括评价肿瘤局部侵犯的范围、淋巴结转移及远处器官转移等),以指导临床决策并用于疗效评价。
腹盆腔超声:主要用于宫颈局部病变的观察,同时可以观察淋巴结转移情况。
盆腔MRI:子宫颈癌最佳影像学检查方法,有助于病变的检出、大小及位置的判断,尤其对活检为CIN3的患者可用于除外内生性病变。
腹盆腔CT:优势主要在于显示中晚期病变方面,评价宫颈病变与周围结构(如膀胱、直肠等)的关系、淋巴结转移情况,以及大范围扫描腹盆腔其他器官是否存在转移;对于有磁共振成像禁忌证的患者可选择CT检查。
胸部射线摄影及胸部CT检查:主要目的是为了排除肺转移和纵隔淋巴结转移。
核医学影像检查:不推荐使用PET-CT评价宫颈癌的局部浸润情况,但对于下列情况,推荐有条件者使用:
(1)FIGO分期为 IB1期及以上的初诊患者治疗前分期(包括 IB1期有保留生育功能需求的患者);
(2)因其他原因行单纯子宫切除术意外发现宫颈癌拟全身评估者;
(3)拟行放射治疗需影像辅助勾画靶区;
(4)存在高危因素的患者治疗结束3~6个月后随访监测;
(5)随访过程中可疑出现复发转移的患者,包括出现临床症状或相关肿瘤标志物升高。
膀胱镜、直肠镜:临床上怀疑膀胱或直肠受侵的患者应对其进行相应腔镜检查。
五、子宫颈癌的分期
目前采用的是FIGO 2018年会议修改的宫颈癌临床分期标准。

点击图片可放大查看
六、治疗
1、宫颈镜下浸润癌(微小浸润癌)
IA期诊断需行锥切,对切缘阴性的锥切标本进行细致的病理检查。
IA1期无生育要求者可行筋膜外全子宫切除术(I型子宫切除术)。因IA1期淋巴结转移率<1%,目前认为IA1期无需行淋巴结切除术。如淋巴脉管间隙受侵,可行宫颈锥切术(切缘阴性)或改良根治性子宫切除+盆腔淋巴结切除术。
IA2期宫颈癌淋巴结转移率约为3%~5%,可行次广泛子宫切除术(II型改良根治性子宫切除术)加盆腔淋巴结切除术。
2、宫颈浸润癌
IB1、IB2、IIA1期:采用手术或放疗,预后均良好。手术方式为III型根治性子宫切除术+盆腔淋巴结切除术±腹主动脉淋巴结取样术。
IB3、IIA2期,可选择的治疗方法如下:
① 同步放化疗;
② 根治性子宫切除及盆腔淋巴清扫、腹主动脉淋巴结取样、术后个体化辅助治疗;
③ 新辅助化疗后手术;
④ 同步放化疗后辅助子宫切除术。
以上方法首选同步放化疗。目前新辅助化疗后再手术对于宫颈癌患者预后的影响还存在争议,故一般推荐在临床试验中或者无放疗条件的区域,对于放疗相对不敏感的病理类型(如腺癌)尤其适合。
IB期患者总的5年生存率约80%~90%,其中宫颈肿瘤直径大于4 cm,有淋巴结转移、宫旁受侵和/或切缘阳性等高危因素者5年生存率仅40%~70%。对部分早期初治宫颈癌患者选择治疗方法时,应考虑到有高危因素的患者可能选择放化疗更为有利。
IIB~ⅣA期:同步放化疗。
ⅣB期:以系统治疗为主,支持治疗相辅助,部分患者可联合局部手术或个体化放疗。
外科治疗决策
筋膜外子宫切除术(I型或A型)可采取经阴道或开腹或微创(腹腔镜及机器人腹腔镜)途径入路。而对于根治性子宫切除术,目前研究表明,与开腹入路相比,微创入路治疗后无病生存率和总体生存率较低。
宫颈癌手术中淋巴结切除范围涉及盆腔淋巴结及腹主动脉淋巴结。IA1(伴 LVSI)至IIA期均应行盆腔淋巴结切除术±腹主动脉旁淋巴结取样术。系统性淋巴结切除术及前哨淋巴结定位切除均可通过开腹、腹腔镜及机器人腹腔镜途径完成。
I~IIA期宫颈鳞癌的卵巢转移率低于1%,对要求保留卵巢功能的未绝经患者术中可以保留外观正常的卵巢。宫颈腺癌发生隐匿性卵巢转移的概率较高,故保留卵巢应慎重。术中可将所保留的卵巢进行移位,以避免术后盆腔放疗对卵巢功能的损伤。
近年来对一些渴望生育的早期、无淋巴结转移的年轻宫颈癌患者施行保留生育功能的手术。IA1期无LVSI可行切缘阴性的宫颈锥切术,如病变范围广可行宫颈切除术;IA1伴LVSI及IA2期患者可行切缘阴性(阴性切缘宽度最好达3 mm)的宫颈锥切术/宫颈切除术+经腹或腹腔镜下盆腔淋巴结切除术±腹主动脉旁淋巴结取样术,或实施经腹、经阴道或腹腔镜下根治性宫颈切除术+盆腔淋巴结切除术±腹主动脉旁淋巴结取样术;IB1期(<2 cm)采用根治性宫颈切除术+盆腔淋巴结切除术±腹主动脉旁淋巴结取样术。对于IA2~IB1期伴LVSI及IB2 期的患者是否可行保留生育功能的手术,目前尚无统一结论,需慎重考虑。
放射治疗
放疗包括体外照射和近距离放疗及二者联合应用。同步放化疗较单纯放疗提高了疗效,降低了复发风险。早期宫颈癌患者手术后早期子宫颈癌患者手术后病理学检查发现高危因素(手术切缘阳性、宫旁受侵、淋巴结转移等) 或中危因素(表2),术后需辅助盆腔放疗或放化疗。
表2 宫颈癌合并中危因素者术后盆腔放疗指征
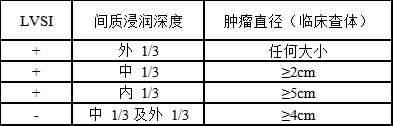
点击图片可放大查看
1、体外照射
以CT或MRI为基础的计划设计和适形遮挡技术是目前外放射治疗的标准治疗方法。
2、近距离照射
将密封的放射源直接放入人体的天然管腔内(如子宫腔、阴道等)为腔内照射。放射源直接放入肿瘤组织间进行照射为组织间照射,二者同属于近距离照射。
3、腔内照射与体外照射的组合
除极少数早期宫颈癌只行腔内照射外,均需腔内及体外联合照射,在宫颈癌的靶区内组成剂量分布较均匀的有效治疗。总的放疗时间尽量限制在8周内完成。
4、放疗并发症
近期并发症:包括治疗中及治疗后不久发生的并发症,如感染、阴道炎、外阴炎、皮肤干湿性反应、骨髓抑制、胃肠反应、直肠反应、膀胱反应和机械损伤等。
远期并发症:常见的依次为放射性直肠炎、放射性膀胱炎、皮肤及皮下组织的改变、生殖器官的改变、放射性小肠炎等。
化学治疗
1、同步放化疗
在放疗的同时进行的化疗,也称为增敏化疗。目前NCCN治疗指南推荐在放疗期间进行含铂类方案的增敏化疗,首选顺铂周疗:30~40 mg/m2,每周1次。顺铂毒性不耐受可用卡铂替换。
2、新辅助化疗
新辅助化疗是指患者在手术前行2~3个疗程的化疗,目的在于缩小肿瘤体积,消灭微转移灶和亚临床病灶,使原来不能手术的患者获得手术机会。目前,主要用于局部肿瘤大的早期患者,最常用的为紫杉醇+顺铂。
3、系统性化疗
系统性化疗主要用于既不能手术也不能放疗的复发或转移性宫颈癌患者。一线化疗方案有顺铂联合紫杉醇、顺铂联合紫杉醇及贝伐珠单抗、紫杉醇联合拓朴替康及贝伐珠单抗。
随访
治疗结束最初2年内每3个月1次、第3~5年每6个月1 次,然后每年随诊1次。II期以上患者治疗后3~6个月复查时应全身MRI或CT检查评估盆腔肿瘤控制情况,必要时行PET-CT检查。宫颈或阴道细胞学检查,根据临床症状提示行必要的实验室检查及其他影像学检查。连续随诊5年后根据患者情况继续随诊。






 2022
2022