作者:周晖a,王东雁a,罗铭b,林仲秋a
作者单位:中山大学孙逸仙纪念医院,a.妇科,b.放疗科,广东 广州 510120
通讯作者:林仲秋,电子信箱:lin-zhongqiu@163.com
子宫颈癌是最常见的女性恶性肿瘤之一,其发病率居恶性肿瘤的第4位,仅次于乳腺癌、结直肠癌及肺癌。2020年数据显示,全球年新发病例约604 000例,死亡约342 000例。子宫颈癌在中低收入国家更为常见,发病率和病死率位居第3位。约85%的新发病例及90%的死亡病例发生在经济欠发达地区。
1 早期筛查与预防
控制子宫颈癌发病的2个主要方法是:(1)通过人乳头瘤病毒(HPV)疫苗预防子宫颈癌。(2)筛查癌前病变。世界卫生组织(WHO)呼吁全球采取措施,遵循“90%-70%-90%”三大策略,即90%女孩在15岁之前接种2剂HPV疫苗;70%女性在35~40岁采取高水平检验筛查子宫颈癌;90%发现子宫颈病变的女性得到治疗和护理。到2030年之前消灭子宫颈癌这一公共卫生问题。
1.1 子宫颈癌的一级预防:子宫颈癌疫苗 HPV主要是通过性生活途径传播。预防性HPV疫苗接种作为预防措施策略应该重点针对开始性活动之前的女性,尤其是10~14岁的女孩。目前许多国家可提供3种预防性HPV疫苗:二价疫苗针对HPV16和18;四价疫苗针对HPV16、18、6和11;九价疫苗针对HPV6、11、16、18、31、33、45、52、58。后2种疫苗除了预防癌前病变及癌症外,还可预防由HPV6、11感染所致的肛门生殖器疣。以上3种疫苗均为由病毒样颗粒(VLPs)组成的重组疫苗,不携带病毒基因,因此没有传染性。对于9~14岁的女孩和男孩,建议使用2针方案(0.5mL,0和5~13个月)。如果第2针是在第1针之后5个月内注射,则建议加用第3针。对于15岁以上和免疫力低下的人群,则无论年龄大小,建议使用3针方案(0.5mL,0、1、6个月)。WHO目前数据显示,HPV疫苗不存在安全性问题。接种疫苗在预防高危型HPV感染及减少肛门生殖器疣和高级别子宫颈病变方面有效。对于疫苗未覆盖的HPV型别也有交叉保护作用。有研究报道了单针注射预防高危型HPV感染有一定效果,但尚需长期随访加以证实。
1.2 子宫颈癌的二级预防:早期发现和治疗癌前病变 在疫苗问世后的近几十年内,筛查仍将是子宫颈癌预防的首选。通过检测和治疗癌前病变,包括高级别子宫颈上皮内瘤变(CIN2和CIN3)及原位腺癌(AIS)预防癌症的发生。筛查方法包括传统细胞学检查(巴氏涂片)及液基细胞学、HPV检测、冰醋酸染色后肉眼观察(VIA)。子宫颈涂片仍是主要的筛查方法。鉴于10年前推广HPV疫苗接种后HPV感染率有所下降,许多医疗保健系统正开始改用HPV初筛。HPV初筛具有更高的敏感度和阴性预测值,允许延长筛查间隔,甚至在低收入国家,一生可仅筛查1次。VIA是在子宫颈上涂布新鲜制备的3%~5%醋酸,1min后观察醋白病灶。在撒哈拉非洲以南的低收入国家已广泛实施。不同国家应因地制宜选择子宫颈癌筛查方法。遵循“可行、简单、准确、可接受、最高危的女性容易使用”的筛查策略选择原则。通过疫苗接种联合筛查,未来消灭子宫颈癌存在巨大的可能性。
2 国际妇产科联盟(FIGO)分期
子宫颈癌可通过直接蔓延转移到宫旁、阴道、子宫和邻近器官(即膀胱和直肠),也可通过淋巴管转移到区域淋巴结,即闭孔、髂外、髂内淋巴结,然后再到髂总和主动脉旁淋巴结。晚期还可通过血缘途径转移至肺部、肝脏和骨骼等远处器官。FIGO 2018子宫颈癌分期见表1。

3 诊断与评估
3.1 微小浸润癌 ⅠA1和ⅠA2期的诊断基于子宫颈环形电切术(LEEP)或冷刀锥切完整病灶的镜下检查,也可以用子宫颈切除或全子宫切除的标本进行诊断。浸润深度从原发灶起源的上皮或腺体基底膜向下分别不应大于3mm或5mm。水平浸润宽度因不影响预后,不再纳入分期。淋巴脉管间隙浸润(LVSI)虽不改变分期,但会影响治疗决策。肿瘤扩散到子宫体不影响分期、预后和治疗方案。锥切切缘仍有浸润癌则诊断为ⅠB1期。临床可见的病灶均诊断为ⅠB期。
3.2 浸润癌 活检可用于肉眼可见病灶的诊断,不满意情况下可采用小LEEP或锥切。临床评估仍然最重要。有条件者可利用影像学辅助评估。允许采用任何可用的影像学方法(如超声、CT、MRI、PET-CT)提供肿瘤大小、淋巴结状态、局部或全身转移的信息。对于直径>10mm的原发肿瘤,MRI是最佳影像学评估方法。有经验的超声医生诊断也具有参考价值。在检测直径>10mm的淋巴结方面,PET-CT比CT和MRI更准确,假阴性率为4%~15%。在结核和炎症高发区,尤其是人类免疫缺陷病毒(HIV)流行区,大的淋巴结未必是转移。医生可根据影像学检查或细针穿刺抽吸或活检来确定或排除转移。晚期患者经微创或开腹手术评估主动脉旁淋巴结是否转移、明确疾病范围有利于制定治疗方案。有文献报道,使用手术分期排除主动脉旁淋巴结转移者预后好于使用影像学排除者。文献报道,治疗前行腹主动脉旁淋巴结(PALNS)分期术,结果显示18%(8%~42%)的ⅠB~ⅣA期患者存在腹主动脉旁淋巴结转移;手术并发症的平均发生率为9%(4%~24%),淋巴囊肿是最常见的并发症。另一研究显示,临床诊断ⅡB期和Ⅲ期的患者其腹主动脉旁淋巴结阳性率分别是35%和20%。这些病例按新分期归为ⅢC期,因为有淋巴结转移者预后更差。盆腔淋巴结阳性为ⅢC1期;腹主动脉旁淋巴结受累则为ⅢC2期。需记录此分期是基于影像学检查(r)还是病理学证实(p)。以便对数据进行相应的分析和报告。
生化检查非必须。浸润性癌患者应行X线胸片检查并通过泌尿系统超声、静脉肾盂造影、CT或MRI评估是否有肾积水。有临床症状时需行膀胱镜或乙状结肠镜检查评估膀胱和直肠情况。桶状型子宫颈管癌及肿瘤累及阴道前壁者也推荐膀胱镜检查。可疑膀胱或直肠受累应通过活检和病理学证据证实。泡状水肿不纳入Ⅳ期。
3.3 病理分期 手术标本或影像引导的细针穿刺细胞病理学报告是评估病灶范围的重要依据。病理学及影像学方法需记录以备后续评估。两者均为分期依据。修订后的FIGO分期与TNM分期接近。
3.4 组织病理 所有子宫颈癌患者均需经病理确诊,且原发部位为子宫颈。组织类型按照WHO 2020年女性生殖器官肿瘤分类描述。(1)鳞状上皮肿瘤:HPV相关鳞状细胞癌;非HPV相关鳞状细胞癌;未分类鳞状细胞癌。(2)腺上皮肿瘤:未分类腺癌;HPV相关腺癌;非HPV相关腺癌:非HPV相关胃型腺癌;非HPV相关透明细胞癌;非HPV相关中肾型腺癌;非HPV相关未分类腺癌;未分类子宫内膜样腺癌;未分类癌肉瘤;腺鳞癌;黏液上皮样癌;腺样基底癌;未分类未分化癌。(3)上皮间质混合肿瘤:腺肉瘤。(4)生殖细胞肿瘤:内胚窦瘤;卵黄囊瘤未分类;绒癌未分类。
4 治疗
子宫颈癌以手术和放疗为主,化疗为辅。
4.1 手术治疗 适用于早期子宫颈癌。可根据期别和扩散程度选择锥切、全子宫切除、广泛性子宫切除等。表2显示广泛性子宫切除术的类型。经选择合适的ⅣA期患者可考虑行盆腔廓清术。
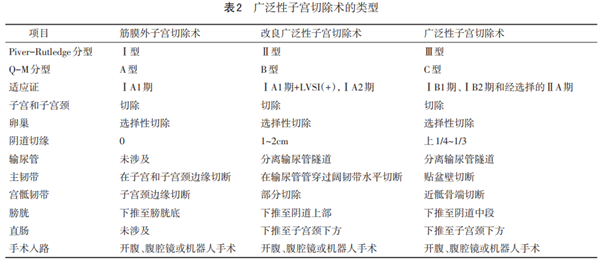
4.1.1 微小浸润癌:FIGOⅠA期
4.1.1.1 ⅠA1期 先锥切。需保留生育功能者若LVSI(-)、切缘阴性可随访;不需保留生育功能者推荐筋膜外全子宫切除术。手术可选择开腹、经阴道或经腹腔镜进行。LVSI(+)者应行筋膜外全子宫+盆腔淋巴结切除术,需保留生育功能者行锥切+盆腔淋巴结切除术。
4.1.1.2 ⅠA2期 此期有淋巴结转移风险,需行B型广泛性子宫切除术+盆腔淋巴结切除术。在低风险病例中,单纯全子宫切除术或子宫颈切除术加盆腔淋巴结切除术或前哨淋巴结(SLN)切除可能已足够。保留生育功能者可选择:(1)子宫颈切除术+盆腔淋巴结切除术(经腹、经阴道或微创)。(2)广泛性子宫颈切除术+盆腔淋巴结切除术(经腹、经阴道或微创)。
4.1.2 浸润癌:FIGOⅠB1期、ⅠB2期、ⅡA1期 首选治疗方式是手术。通常包括C型广泛性子宫切除术和盆腔淋巴结切除术。手术可采用开腹或者微创,即腹腔镜或者达芬奇机器人手术。关于手术路径的争议,LACC试验(Laparoscopic Approach to Cervical Cancer)比较了开腹手术与腹腔镜或机器人手术治疗早期子宫颈癌的结果,显示微创手术总生存率(OS)下降,术中并发症无区别,微创手术比开腹手术复发率更高。另外7项研究也证实了这些发现,即微创组4年病死率高、5年复发率高等。但是SUCCOR研究显示,局部病灶直径<2cm患者开腹和微创手术对肿瘤结局并无影响,微创术中使用过举宫器的复发风险高2.76倍,而采用了保护性阴道闭合者复发率与开腹组相近。尚有2项前瞻性研究等待结果。
4.1.2.1 FIGOⅠB1期 标准治疗方式是C型广泛性子宫切除术。低危患者也可考虑行改良广泛性子宫切除术。低危患者定义:子宫颈间质浸润小于50%,影像学无淋巴结转移。该期淋巴结转移风险高,应予切除。一项对比广泛性子宫切除术和单纯全子宫切除术对早期低危患者肿瘤结局的研究(NCT01658930)正在进行中。GOG 278研究针对低危患者采用非广泛性手术(全子宫切除或锥切+盆腔淋巴结切除,探讨其对生存质量的影响。广泛性子宫切除术建议保留盆腔神经。自主神经(即腹下神经、内脏神经和盆腔神经从)盆腔段损伤经常会导致排尿、排便和性功能障碍并伴随生存质量(QOL)下降。
保留生育功能的ⅠA2~ⅠB1期患者可行广泛性子宫颈切除术和盆腔淋巴结切除术,切除子宫颈及宫旁组织,将子宫和阴道断端吻合。手术可经腹、经阴道或腹腔镜进行。经阴道手术者,先用腹腔镜切除盆腔淋巴结并送冰冻病理检查以确保淋巴结阴性,然后再行经阴道广泛性子宫颈切除术;也可以先腹腔镜切除盆腔淋巴结,等常规病理检查评估淋巴结状况1周后,再行二次经阴道完成广泛性子宫颈切除术。
4.1.2.2 FIGOⅠB2/ⅡA1期 初始治疗包括手术或放疗,取决于患者因素和当地卫生资源,手术和放疗疗效相当。手术优势:(1)可根据组织病理结果进行准确的术后分期,为患者制定后续个体化治疗方案。(2)去除耐放疗肿瘤。(3)可保留卵巢功能:术后需要放疗的患者,术中可将卵巢移位至远离放射野、高至结肠旁沟位置。手术是需要保留卵巢和性功能的年轻女性首选治疗方式。C型广泛性子宫切除术是子宫颈癌手术的基本术式,切除范围包括子宫、宫旁、阴道上段、部分阴道旁组织及盆腔淋巴结。邻近的结缔组织,包括前方的膀胱子宫颈韧带(前后叶)、侧方的主韧带,后方的宫骶韧带和直肠阴道韧带,也需切除足够的长度。盆腔淋巴结切除术是该术式的基本步骤之一,切除范围包括宫旁淋巴结、闭孔、髂内、髂外和髂总淋巴结。
前哨淋巴结显影尚处于试验阶段,需有更多证据才能纳入常规推荐。早期即ⅠA~ⅠB2期可能发挥作用。使用蓝色染料和放射性胶体进行双重显影可提高准确性。吲哚菁绿染料近红外技术已被应用于开放和微创术中。LVSI(+)者需考虑切除盆腔淋巴结。
4.1.3 FIGOⅠB3/ⅡA2期 局部大块病灶易合并其他高危因素如淋巴结阳性、宫旁阳性或阴道切缘阳性,均增加复发风险和术后辅助放疗的可能性。除了淋巴结转移,其他增加盆腔复发风险的危险因素包括:肿瘤最大径线>4cm,LVSI(+),浸润子宫颈外1/3间质。对于这部分患者术后辅助盆腔外照射可减少局部复发并改善无进展生存期。但是双重治疗会增加患者发生严重并发症的风险。治疗方式的选择取决于可采用的资源以及肿瘤和患者的相关危险因素。铂为基础的同期放化疗(CCRT)是ⅠB3/ⅡA2期患者首选治疗,优于手术加术后辅助放疗。
放疗设施稀缺地区,可考虑应用新辅助化疗(NACT),其作用包括:(1)降分期以提高手术的彻底性和安全性。(2)控制微转移和远处转移。新辅助化疗与标准治疗相比是否能改善预后尚有争议。新辅助化疗后手术范围不能缩小,仍为广泛性子宫切除术和盆腔淋巴结切除术。新辅助化疗可能改变病理结果从而影响评估辅助放疗/同期放化疗的适应证,所以新辅助化疗后很难确定是否需要辅助治疗。建议新辅助化疗仅用于临床研究或者缺乏放疗设备的地区,需要注意的是特别大的巨块病灶和腺癌对新辅助化疗的反应率较低。
4.1.4 FIGO ⅣA期或复发子宫颈癌 ⅣA期仅有中心病灶但未累及骨盆或远处转移的患者极少。初治或复发时属于这种情况可考虑盆腔廓清术,通常预后不良。
4.1.5 FIGO ⅣB期/远处转移 子宫颈癌远处转移患者较为少见,约2%。治疗计划应考虑到患者的中位生存期仅约7个月。仅发现腹主动脉旁和锁骨上淋巴结阳性远处转移的患者,同期放化疗可能比全身化疗反应更好,其总生存率和无病生存率分别为69%和57%。预防性扩大野外照射(EFRT)在局部晚期子宫颈癌中没有作用;但当腹主动脉旁淋巴结受累时,应采取EFRT联合同期化疗。调强放疗可用于此类患者以减少不良反应。尽管反应率有限,顺铂仍然是有远处转移患者的标准化疗药物。考虑到同期放化疗后单用顺铂的反应率较低,最近的证据支持以顺铂为基础的双药化疗。顺铂可与紫杉醇、拓扑替康、氟尿嘧啶、吉西他滨或长春瑞滨联合使用。卡铂联合紫杉醇也已经在这些病例中获得成功。
美国东部肿瘤协作组(ECOG)建议对于体力状态评分0~2分的患者考虑姑息性化疗,也可参加临床试验,尤其是当复发间隔小于12个月时。GOG 240研究了贝伐珠单抗的治疗效果,用于治疗复发性和转移性子宫颈癌时,总生存率增高(17.0个月 vs. 13.3个月,死亡HR为0.71,98%CI 0.54~0.95,单侧检验P=0.004)。贝伐珠单抗的不良反应包括增加高血压、血栓、肠瘘的发生等。
4.2 放射治疗 在中低收入国家,大多患者发病时为局部晚期。放疗具有更重要的作用。放射治疗除根治作用外,还可作为术后辅助治疗以减少局部复发,也可以作为姑息治疗缓解晚期无法治愈患者的痛苦。
4.2.1 早期子宫颈癌的放射治疗(FIGO ⅠA、ⅠB1、ⅠB2、ⅡA1期) 尽管早期子宫颈癌首选手术治疗,放疗对于有手术或麻醉禁忌证的患者在局部控制和生存率方面有同样的效果。治疗的决策应该依据临床、疾病范围和社会因素。合并内科疾病无法手术的微浸润子宫颈癌患者,采用单独腔内放疗(ICRT)也能取得良好效果。肿瘤直径小于1cm的ⅠB1期患者也可以接受ICRT,特别是有外照射放疗(EBRT)相对禁忌证者。A点通常给予60~65Gy等效剂量。联合使用EBRT和ICRT也是此类患者的治疗选择之一。经评估需要术后补充放疗可能性大的患者,应首选广泛性放疗或同期放化疗以避免手术联合放疗产生的相关并发症。同期放化疗是现在广泛性放疗患者的标准治疗方式。有研究比较了ⅠB期或ⅡA期患者手术±术后放疗(PORT)和单纯根治性放疗,两组总生存率(83%)和无病生存率(74%)相似,手术组严重并发症发生率更高(28% vs. 12%);同一试验20年随访数据的更新显示放疗和手术相比生存率略有改善(77% vs. 72%,P=0.020)。多因素分析证实组织病理类型(P=0.020)、肿瘤直径(P=0.008)、淋巴结状态(P<0.001)是生存相关危险因素。
4.2.2 辅助放疗 在广泛性子宫切除术后,推荐有不良病理因素的患者接受加或不加化疗的术后放疗。不良预后因素可分为高危、中危和低危。高危因素包括手术切缘阳性、淋巴结转移或者宫旁扩散,应接受联合化疗的术后放疗,因为GOG109研究发现了总体生存优势。在3个危险因素(肿瘤直径>4cm、LVSI、子宫颈深间质浸润)中,存在2个因素归为中危患者,需术后放疗,但可不加同期化疗;没有或只有1个因素的患者归为低危,无需辅助治疗。肿瘤直径超过2cm是保留生育功能的一个危险因素。有学者观察到,在肿瘤直径≥2cm及LVSI阳性的患者中,有89%术后接受了放疗。因此,建议早期患者应评估肿瘤大小和LVSI,以便调整治疗方案,减少根治性手术和放化疗双重治疗。术后放疗应包括覆盖瘤床和淋巴结引流区域的全盆腔外照射放疗。通常剂量为45~50Gy。调强放疗是一种先进和精细的放射技术,可减少术后放疗的不良反应。外照射放疗后阴道近距离治疗推量的作用尚不明确,切缘阳性或肿瘤靠近切缘、肿瘤直径大或子宫颈深间质浸润、宫旁或阴道受累或广泛LVSI者可考虑应用。通常采用卵圆形或圆筒状施源器对阴道残端的上1/3段行近距离放疗,应包括1周2次的高剂量近距离放疗,每次6Gy,参考点为阴道圆形或卵圆形施源器外5mm。
4.2.3 FIGOⅠB3/ⅡA2期的放射治疗 尽管ⅠB3期和ⅡA2期可选择手术治疗,但不推荐初治首选手术治疗。因为80%患者需要术后放疗或同期放化疗。手术加放疗会增加并发症从而影响生存质量。双重治疗模式也增加了不必要的手术和放疗资源负担。因此,同期放化疗是ⅠB3期和ⅡA2期的标准治疗方法。同期放化疗包括外照射和腔内近距离放疗。
4.2.4 FIGO ⅡB~ⅣA期的放射治疗 同期放化疗是局部晚期子宫颈癌患者的标准治疗方案。有研究结果显示,同期放化疗与单纯放疗相比,5年生存率提高了10%~15%,局部复发及远处转移率均下降。之后的1项Meta分析结果显示,在ⅠB3期行同期放化疗最多有6%的患者获益,而ⅡB期患者只有3%。化疗方案是外照射过程中每周1次顺铂(每周40mg/m2加上适当的水化),共5~6个周期。无法接受铂类化疗者,氟尿嘧啶是替代方案。关于同期化疗联合扩大照射野放疗毒性方面的数据尚不足。外照射放疗结合单独腔内放疗最大程度提高了局部控制率,减少了治疗并发症。外照射放疗的作用是消灭局部病灶,使肿瘤退缩,有利于后续的单独腔内放疗。标准的外照射放疗应通过2或4野的盒式技术(表3)覆盖宫体、子宫颈和附件结构、宫旁以及盆腔淋巴结,对全盆腔给予45~50Gy的放疗剂量。虽然在一些资源匮乏的国家,外照射放疗通常由钴60远程治疗机提供,但是现在首选直线加速器,因为它们能提供更高能量束,在深部组织有更均匀的剂量分布,浅表组织相对少散射。为减少正常组织的照射毒性,越来越多应用3D-CRT和调强放疗等适形放疗技术。
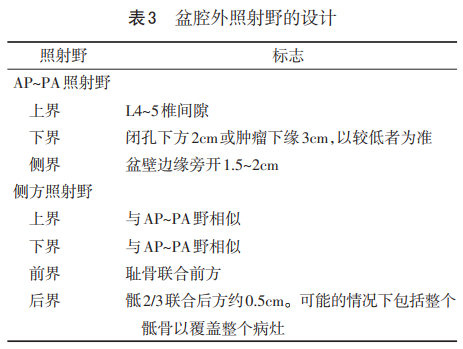
标准的单独腔内放疗通常选用1个宫腔管和2个椭圆体或者1个宫腔管和1个环。任何剂量率系统,包括低剂量率(LDR)、高剂量率(HDR)或者脉冲式剂量率(PDR),均可行,因为治疗后的生存率相当。如果是图像为基础的计划,处方剂量是针对A点或者高危临床靶体积。30~40Gy分1或2个治疗模式。对HDR剂量系统,采用不同剂量分割,以分割剂量为每周1次,5.5~8Gy/次,共3~5次。在放疗资源匮乏和较偏远地区,使用3次分割放疗比5次更现实,并且可以治疗更多患者。在当前的情况下,低分割(提高每天剂量,减少分割次数)可以减少去医院的次数。外照射放疗加上单独腔内放疗的总剂量应该在80~90Gy。尽管很少用到PDR,但PDR的总治疗时间和剂量与LDR一样,这种治疗以每小时多次脉冲的方式进行,每次持续几分钟。
因解剖变异或剂量不足导致单独腔内放疗不可行时,应考虑组织间插植近距离放疗。组织间插植近距离放疗包括在模具帮助下穿过会阴,将多根针或导管插入原发肿瘤和宫旁组织中。建议在超声成像下(特别是经阴道超声)进行插植以避免损伤膀胱和直肠等正常组织。
回顾性分析显示,放疗时间超过9~10周的患者与6~7周内完成放疗的患者相比具有更高的盆腔治疗失败率。因此,在规定时间内完成放疗方案尤为重要,建议8周内完成外照射放疗和近距离放疗。
5 随访
研究显示,子宫颈癌初治后中位复发时间是7~36个月。治疗后2~3年内随访很重要。建议前2~3年每3~4个月随访1次,然后每6个月随访1次至5年,此后每年随访1次至终身。每次随访,需采集病史和进行临床检查,了解治疗并发症和性心理障碍的发生率,评估疾病复发。常规影像学检查并非必要。若原有盆腔淋巴结转移,需要定期行腹部影像学检查。通过体格检查(29%~71%)、胸部X线检查(20%~47%)、CT(0~34%)和阴道穹隆细胞学检查(0~17%)发现无症状的复发性病变。频繁的阴道穹隆细胞学检查并不能明显提高早期复发的发现率。50岁以下切除卵巢的女性可考虑接受激素替代治疗。后续常规检查应包括甲状腺和肾脏状况的评估及其他以年龄为指导的健康体检以保证生存质量。
6 复发
复发可能发生于盆腔或腹主动脉旁,或远处转移,或两者兼有。盆腔和远处转移的风险随着肿瘤体积的增大而增加。多数复发见于3年内且预后差,患者常死于疾病进展,尿毒症是最常见的终末期事件。复发的治疗方案取决于患者的体力状态、复发和(或)转移的部位和范围及以往所接受的治疗。对于存在广泛局部转移或远处转移的患者,应给予最好的支持治疗和控制症状的姑息性治疗。对于精神状态良好并且转移病灶局限的患者,行含铂双药加贝伐珠单抗全身化疗。
6.1 局部复发 盆腔是最常见的复发部位,尚未累及盆壁的孤立的中心性盆腔复发,或初治后无瘤间期长和复发病灶直径小于3cm是预后良好的因素。初治术后盆腔复发,可行根治性放化疗或盆腔廓清术。在进行任一治疗前,活检获得病理标本确认复发是必要的。加或不加同期化疗的根治性放疗用于初始术后的孤立盆腔复发患者5年无瘤生存率为45%~74%。复发病灶范围和盆腔淋巴结累及状况是影响生存的预后因素。顺铂和(或)氟尿嘧啶同期放化疗可能改善治疗效果。盆腔廓清术适用于没有明显腹腔内或骨盆外扩散的患者,并且在复发病灶和盆腔侧壁间存在明显的无瘤间隙。由于术后病率高,盆腔廓清术仅用于那些有潜在治愈可能的患者,需要就身体和心理需求慎重挑选病例,同时需就手术并发症及造口等问题与患者进行沟通。术前需行PET-CT扫描排除任何部位的远处转移。盆腔廓清术总生存率为10%,但经仔细选择的患者5年生存率为30%~60%,手术病死率低于10%。
6.2 腹主动脉旁淋巴结复发 腹主动脉旁淋巴结是第二常见的复发部位。孤立腹主动脉旁淋巴结复发患者约30%可通过根治放疗或同期放化疗获得长期生存。
7 姑息治疗
目的是控制症状以维持生命尊严和生存质量。晚期子宫颈癌常见的症状包括疼痛、输尿管阻塞引起的肾功能衰竭、出血、阴道恶臭分泌物、淋巴水肿和瘘。患者需要相应的临床服务,实施疼痛分级管理。口服吗啡在中低收入国家是姑息治疗的一个重要方法。晚期难治患者常出现与转移性病变相关的症状,短程放疗可用于缓解此类症状。通常使用1周5个分割剂量的20Gy或2周10个分割剂量的30Gy。严重阴道流血的患者可尝试短疗程的外照射放疗;若失败,单独腔内放疗可以非常有效地控制顽固性出血,出血通常在放疗后12~48h得到控制。腹主动脉旁淋巴结或锁骨上淋巴结肿大导致的疼痛、骨转移和脑转移相关症状的患者,应在更短的时间内给予大分割剂量的姑息性放疗。常用大的单次分割剂量方案、5次分割剂量20Gy和10次分割剂量30Gy。
8 特殊情况
8.1 意外发现的子宫颈癌 因良性疾病行全子宫切除术后行病理检查时意外发现的子宫颈浸润癌常有发生。建议先行PET-CT(如可行)或盆腹部CT或MRI及胸部影像来评估病灶范围。后续治疗计划根据组织学和影像学的发现来制定。尽管术后放疗对意外发现的子宫颈癌有益,但是患者的预后仍然很差,5年无复发生存率为48%,所以经常会加用同期化疗。来自印度的学者报道33例全子宫切除术后意外发现的子宫颈浸润癌和50例广泛性子宫切除术后患者采用术后放疗的结局,前者5年无复发生存率明显较低(分别为49%和72%,P=0.04)。因此,术后放疗不足以弥补不全手术的不足。在技术条件允许下,部分患者可能适于再次开腹手术切除宫旁组织及盆腔淋巴结。由于瘢痕形成、粘连及解剖改变,手术具有挑战性,但是确实有治愈的可能,并可评估是否需要同期放化疗。
8.2 妊娠期子宫颈癌 这类患者的管理需要多学科团队协作,患者及家庭共同参与。总体而言,妊娠期子宫颈癌的管理参照非妊娠期子宫颈癌的处理原则。在妊娠16~20周前发现子宫颈癌应即时治疗,根据疾病分期采用手术或放化疗。放疗常导致自然流产。中孕期后诊断的患者,在维持妊娠的同时,可有选择的行手术和化疗。妊娠20周后诊断的ⅠA2~ⅠB2期患者,推迟根治性治疗是一种选择,与非妊娠患者相比较并未显示不良预后。分娩时机需要权衡母体和胎儿的健康获益。在有适当新生儿护理的三级医疗中心分娩时,可在妊娠34周前行剖宫产的同时行广泛性子宫切除术。推迟治疗对更晚期病例的生存影响尚不清楚。当计划推迟治疗时,采用新辅助化疗可阻止局部晚期子宫颈癌的疾病进展。
9 讨论
FIGO指南对子宫颈癌各期治疗原则与NCCN指南相近,但FIGO指南是面向全世界的指南,更多兼顾了经济欠发达地区的医疗资源、医疗设备水平,无论手术范围和放疗方案,还是新辅助化疗的观点,均与NCCN指南有所不同。
9.1 针对各期子宫颈癌的手术范围有缩小的倾向 如对于无生育要求的ⅠA1期合并LVSI(+)患者,FIGO推荐全子宫加盆腔淋巴结切除,甚至在ⅠA2期低危患者(子宫颈间质浸润<50%,影像学无淋巴结转移)也可仅行全子宫切除术或子宫颈切除术加盆腔淋巴结切除。ⅠB1期低危患者也可考虑行改良广泛性子宫切除术。也提到了正在进行的GOG278临床试验,该研究是针对低危患者仅采用非根治性手术(全子宫切除或锥切)加盆腔淋巴结切除对生存质量影响的临床试验,目前尚未有结论。缩小手术范围降低了对医生手术技能的要求,患者并发症和经济负担也会相应减少,对于经济欠发达、医疗技术水平低的地区有现实意义。在我国,在缩小手术范围确实不影响治疗效果的结论获得充分肯定之前,除非在特别偏远的地区可借鉴这些做法,大部分地区还是应该在完善分级医疗制度、疏通患者转送渠道、加强专科医生培训、提高医生手术水平、加强肿瘤规范化诊治等方面入手。毕竟肿瘤治疗效果始终是最优先级别考虑的问题。
9.2 保留生育功能手术的推荐比较保守 在ⅠA1期中,FIGO将LVSI(+)与LVSI(-)同等推荐,而NCCN指南则将这部分患者升级到ⅠA2期处理。在ⅠA2期中,锥切列为首选,广泛性子宫颈切除术为次选。ⅠB2期FIGO不推荐保留生育功能,NCCN者推荐可选择开腹手术。FIGO还提到了分期手术,即先行腹腔镜盆腔淋巴结切除术,1周后病理结果阴性再行广泛性子宫颈切除术,这也是为了避免术中冰冻切片结果的误差而影响治疗决策。
9.3 选择性推荐新辅助化疗 对于局部晚期子宫颈癌的新辅助化疗,在NCCN指南中仅推荐用于子宫颈小细胞神经内分泌癌这一对化疗相对敏感的病理类型。FIGO则推荐可用于临床试验和放疗设备匮乏的地区。同时也提到需要注意特别大的巨块病灶和腺癌对新辅助化疗的反应率较低。对于新辅助化疗患者应该加以选择。
9.4 FIGO对于广泛性子宫切除术的微创路径并非全盘否定 不同于NCCN指南明确推荐开腹广泛性子宫切除术是标准的手术路径,FIGO推荐了开腹和微创路径,但同时也提到LACC等临床试验微创路径复发率较高、生存率较低的临床数据。FIGO也提到了局部病灶直径<2cm患者开腹和微创对肿瘤结局无影响,以及微创术中不使用举宫器和采用保护性阴道闭合的改进措施。目前还需要更多的开腹和微创路径对肿瘤结局影响的前瞻性研究结果。
9.5 放疗部分更新 在当前情况下,低分割(提高每天剂量,减少分割次数)单独腔内放疗可以减少就医次数。这也是FIGO全球观念的一个体现。
表4总结了FIGO指南和NCCN指南推荐的异同,便于大家理解。







 2022
2022